卫健委发布《宫颈癌诊疗规范(2018年版)》
2019-01-09 来自: 河南大尧生物技术有限公司 浏览次数:1461
为了规范宫颈癌的诊治,卫健委发布了《宫颈癌诊疗规范(2018年版)》。本指南适用于宫颈鳞癌、腺癌及腺鳞癌,占所有宫颈癌的90%以上。

宫颈癌是常见的妇科恶性肿瘤之一,发病率在我国女性恶性肿瘤中居第二位,位于乳腺癌之后。我国每年约有新发病例13万,占世界宫颈癌新发病例总数的28%。患病的高峰年龄为40~60岁,近年来大量研究表明,宫颈癌的发病年龄呈年轻化趋势。
为了规范宫颈癌的诊治,卫健委发布了《宫颈癌诊疗规范(2018年版)》。本指南适用于宫颈鳞癌、腺癌及腺鳞癌,占所有宫颈癌的90%以上。部分特殊病理类型,如小细胞癌、透明细胞癌、肉瘤等发病率低,目前国内外尚未达成共识,故本指南不适合用于这些少见病理类型的宫颈癌。我们将指南内容进行了整理,供大家参考。

病因学
持续的高危型人乳点瘤病毒(HPV)感染是宫颈癌及癌前病变的首要因素。我国常见的高危型HPV包括16、18、31、33、45、52、58等。HPV主要通过性生活传播。
与宫颈癌相关的其他高危因素有:
①不良性行为:过早开始性生活,多个性伴侣或丈夫有多个性伴侣;
②月经及分娩因素:经期卫生不良,经期延长,早婚,早育,多产等;
③性传播疾病导致的炎症对宫颈的长期刺激;
④吸烟:摄入尼古丁降低机体的免疫力,影响对HPV感染的清除,导致宫颈癌特别是鳞癌的风险增加;⑤长期服用口服避孕药:服用口服避孕药8年以上宫颈癌特别是腺癌的风险增加两倍;
⑥免疫缺陷与抑制:HIV感染导致免疫缺陷和器官手术后长期服用免疫抑制药物导致宫颈癌的发生率升高;
⑦其他病毒感染:疱疹病毒Ⅱ型(HSV-Ⅱ)与宫颈癌病因的联系不能排除。其他因素如社会经济条件较差、卫生习惯不良、营养状况不良等也可能增加宫颈癌的发生率。
临床表现
癌前病变及宫颈癌早期可以没有任何症状。常见的症状为接触性阴道出血,异常白带如血性白带、白带增多,不规则阴道出血或绝经后阴道出血。晚期患者可以出现阴道大出血、腰痛、下肢疼痛、下肢水肿、贫血、发热、少尿或消耗恶液质等临床表现。
辅助检查
宫颈/阴道细胞学涂片检查及HPV检测
宫颈上皮内瘤变(CIN)和宫颈癌的诊断均应有活体组织学检查证实。
阴道镜检查,适用于宫颈细胞学异常者,主要观察宫颈阴道病变上皮血管及组织变化。
临床上怀疑膀胱或直肠受侵的患者,应对其进行相应腔镜检查。没有条件的单位应转上级医院诊治。
对肿瘤转移、侵犯范围和程度的了解可以通过影像学检查实现。
宫颈癌的诊断标准
1. 临床诊断:
主要依据以下症状、体征、实验室和影像学检查:
①早期可无症状和体征,也可出现阴道接触性出血或分泌物增多、异味等。
②晚期可出现阴道大量出血,可导致贫血;肿瘤合并感染可出现发热症状;也可有肾功能衰竭及恶病质情况。
③肿瘤侵犯膀胱可出现血尿,侵犯直肠可出现血便,肿瘤侵透膀胱、直肠可出现瘘。
④实验室检查,肿瘤标志物SCC等异常增高。
⑤影像学检查(超声、MRI、CT)提示宫颈癌,可有宫旁软组织侵犯、肾盂积水、腹膜后淋巴结转移等。
2. 病理诊断:
阴道镜或直视下的宫颈活检病理检查是终确诊的金标准。
宫颈癌的医疗
宫颈癌的分期与医疗方式的选择
1.宫颈镜下浸润癌(微小浸润癌)
即ⅠA期,由于ⅠA期肿瘤的判定依据显微镜下测量,咬取活检标本不能包含全部病变,无法进行病变范围的测量,故正确诊断需行锥切活检,准确地诊断ⅠA期宫颈癌需对切缘阴性的锥切标本进行细致的病理检查。
ⅠA1期无生育要求者可行筋膜外全子宫切除术(I型子宫切除术)。如患者有生育要求,可行宫颈锥切术,切缘阴性则定期随访。
2. 宫颈浸润癌
(1)ⅠB1、ⅡA1期:采用手术或放疗,预后均良好。手术方式为Ⅲ型医治性子宫切除术和盆腔淋巴结切除术±腹主动脉淋巴结取样术。
(2)ⅠB2、ⅡA2(病灶>4cm)期:可选择的医疗方法有:a同步放化疗;b医治性子宫切除及盆腔淋巴清扫、腹主动脉淋巴结取样、术后个体化辅助医疗;c同步放化疗后辅助子宫切除术。
(3)ⅡB~ⅣA期:同步放化疗(具体方案见放射医疗及增敏化疗)。
(4)ⅣB期:以系统医疗为主,支持医疗相辅助,部分患者可联合局部手术或个体化放疗。
外科医疗
手术医疗主要应用于早期宫颈癌。手术包括子宫切除与淋巴结切除两部分。
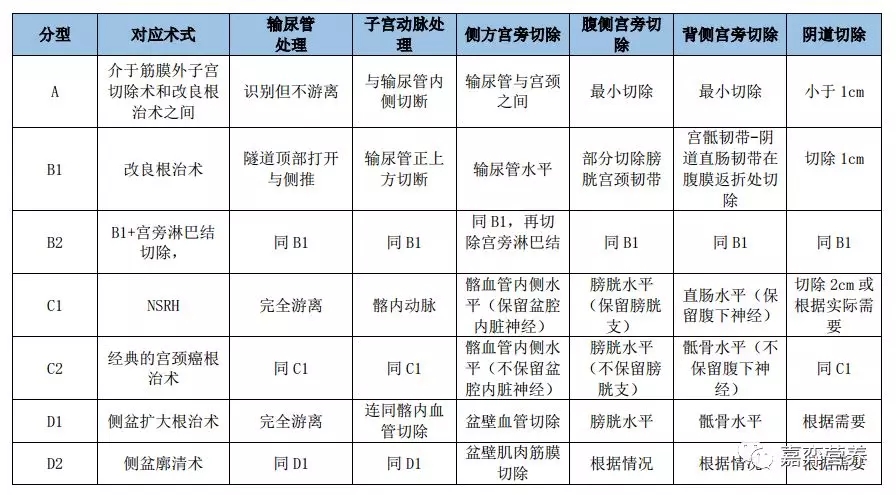
1974年提出的Piver 5型子宫切除手术分类系统至今仍广泛应用。2008年又提出了Q-M子宫切除分型系统(表1)。
Piver手术分型系统如下:
Ⅰ型:筋膜外子宫切除术。(适用于ⅠA1期不伴有LVSⅠ的患者)
Ⅱ型:改良医治性子宫切除术,切除范围还包括1/2骶、主韧带和上1/3阴道。(适用于ⅠA1伴有LVSI及ⅠA2期患者)
Ⅲ型:医治性子宫切除术,切除范围包括毗邻盆壁切除主韧带、从骶骨附着处切除骶韧带及切除上1/2阴道。(为标准的宫颈癌医治手术,适用于ⅠB~ⅡA期患者)
Ⅳ型:扩大医治性子宫切除术。(适用于部分复发患者)
V型:盆腔脏器廓清术。(适用于部分ⅣA期及复发患者)
表1 Q-M宫颈癌医治性手术分型如下:
宫颈癌患者术后需根据复发危险因素选择辅助医疗,以降低复发率,改善预后,详见放射医疗原则部分。
放射医疗
适用于各期宫颈癌。放疗包括体外照射和近距离放疗及二者联合应用。研究表明同步放化疗较单纯放疗提高了疗效,降低了复发风险。
放疗的原则:恶性肿瘤的放疗原则与其他医疗手段一样,要尽可能地杀灭癌细胞,尽可能保护正常组织和重要器官,即尽量提高医疗效果,降低并发症。
1. 体外照射
体外照射剂量参考点:多年来一般均以“B”点为宫颈癌体外照射量的计算点。
常规放疗:即在模拟机或CT模拟机下定位下的放疗。
靶区:一般应当包括子宫、宫颈、宫旁和上1/2阴道,盆腔淋巴引流区如髂内、闭孔、髂外、髂总淋巴结。ⅢA期患者包括全部阴道。必要时包括腹股沟区。采用四野箱式照射或等中心前后对穿照射。应用高能6~12MV X射线。
界限:上界:L5上缘水平;下界:闭孔下缘(ⅢA期患者除外),其端点与设野宽处的连线约通过股骨内1/3;外界:在真骨盆外1.5 ~2.0cm;前界:耻骨联合前缘(据不同肿瘤而定);后界:全部骶骨在照射野内(据不同肿瘤而定)。应用多叶光栅或不规则挡铅屏蔽保护正常组织。
剂量:采用常规分割照射,1.8 ~2.0Gy/次,5次/周。
Ⅰ~Ⅱ期:45Gy/1.8~2Gy/4.5 ~5周,Ⅲ~Ⅳ期:45~50Gy/1.8~2Gy/5~6周。
三维适形放疗及调强适形放疗:以CT或MRI为基础的计划设计和适形遮挡技术是目前EBRT的标准医疗方法。对于不能手术的宫颈癌患者,PET检查有助于确定淋巴结转移的范围,也有助于术后患者是否还有残留阳性淋巴结的诊断。
2. 近距离照射
将密封的放射源直接放入人体的管腔内(如子宫腔、阴道等)为腔内照射。放射源直接放入肿瘤组织间进行照射为组织间照射,二者同属于近距离照射。
腔内放疗是宫颈癌医治性放疗中的重要医疗手段。采用宫腔管联合阴道施源器的腔内医疗方法特别常用。根据患者及肿瘤的解剖特点选择不同的阴道施源器与宫腔管联合使用。后装腔内医疗机根据其对“A”点放射剂量率的高低可分为3类:低剂量率(0.667 ~3.33cGy/min)、中剂量率(3.33 ~20cGy/min)、高剂量率(在20cGy/min以上)。
3. 腔内照射与体外照射的组合
除极少数早期宫颈癌只行腔内照射外,均需腔内及体外联合照射,在宫颈癌的靶区内组成剂量分布较均匀的有效医疗。总的放疗时间限制在8周内完成。
化学医疗
化疗在宫颈癌医疗中的作用越来引起重视主要应于用放疗时单药或联合化疗进行放疗增敏,即同步放化疗。
1. 同步放化疗
是指在放疗的同时进行的化疗,也称为增敏化疗。
目前NCCN医疗指南推荐的在放疗期间增敏化疗的方案有:
顺 :50~70mg/m2 + 5FU:4g/m2(96小时持续静脉滴入),放疗第1和29天。
顺周疗:30~40mg/m2,放疗第1、8、15、22、29和36天。
顺+紫杉方案:顺 :50~70mg/m2,紫杉 135~175mg/m2,放疗第1和29天。
顺+紫杉周疗:顺 :25~30mg/m2,紫杉 60~80mg/m2,放疗第1、8、15、22、29和36天。
2. 新辅助化疗
新辅助化疗(neoadjuvant chemotherapy,NACT)是指患者在手术前行2~3个疗程的化疗,目前,主要用于局部肿瘤大的早期患者。NACT化疗方案常以铂类为基础的联合方案,给药途径包括静脉全身化疗或动脉插管介入化疗。几种方案疗效相近。
3. 姑息化疗
主要用于既不能手术也不能放疗的复发或转移的宫颈癌患者。
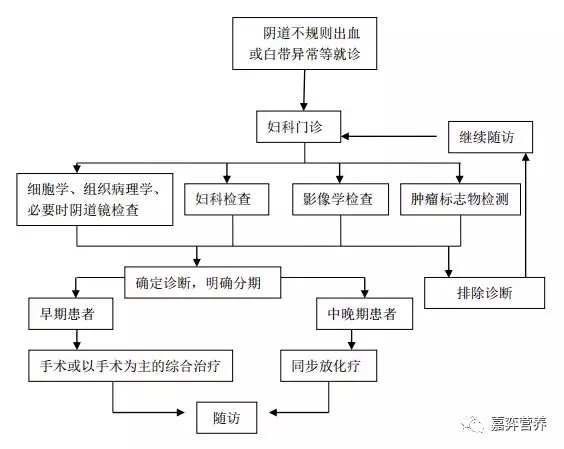
附:子宫颈癌诊断与医疗流程